Hace tan solamente diez años, un paciente con diagnóstico clínico de distrofia hereditaria de retina tenía que enfrentarse a un pronóstico inevitable, pérdida progresiva de visión y ceguera. No había un tratamiento eficaz para curar o detener la progresión de la enfermedad. Recientemente, la implementación de tecnologías de vanguardia ha mejorado considerablemente las perspectivas de futuro de los pacientes y sus familias.
- La secuenciación masiva (NGS) ha revolucionado por completo el diagnóstico genético de las enfermedades raras. Esta metodología permite realizar un análisis rápido y preciso de los genes responsables a un precio asequible. La información genética asegura el diagnóstico clínico, incrementa la fiabilidad del pronóstico, permite el asesoramiento genético y abre la puerta a la medicina de precisión. Es la nueva medicina que diseña tratamientos terapéuticos personalizados para subsanar en cada paciente el defecto genético inicial y restituir la función celular deteriorada.
- Los avances biotecnológicos culminan después de años de investigación básica para: i) generar modelos celulares y animales con modificaciones genéticas específicas que identifican las vías moleculares implicadas en la función visual comparando individuos sanos y afectos, ii) diseñar y construir vectores virales eficaces para transferir los genes terapéuticos, iii) obtener en el laboratorio las células madre adecuadas para la terapia celular, y iv) desarrollar y profundizar en el potencial terapéutico de los materiales nanotecnológicos.
- Como resultado de todos estos estudios se han iniciado, y van en aumento, numerosos ensayos clínicos de terapia génica y celular (con células madre). Los resultados obtenidos superan con creces las expectativas iniciales, tanto en los ensayos de terapia génica basada en la adición de genes y la transferencia de ácidos nucleicos, como en los trasplantes alogénicos o con células derivadas del propio paciente (células iPSCs).
En la Semana Mundial de la Retina, la noticia alentadora es la aprobación de Luxturna, el primer producto de terapia génica aprobado y comercializado para el tratamiento de la amaurosis congénita de Leber y la retinosis pigmentaria, patologías genéticas causadas por mutaciones en el gen RPE65. Este gran avance es solamente el comienzo de una nueva era, ya que actualmente se están realizando más de 15 ensayos clínicos de terapia génica para distintas patologías de la retina, como la retinosis pigmentaria ligada al cromosoma X, la coroideremia, la acromatopsia, la neuropatía óptica hereditaria de Leber (LHON), entre otras. Algunos de estos ensayos clínicos se enumeran en la siguiente tabla.
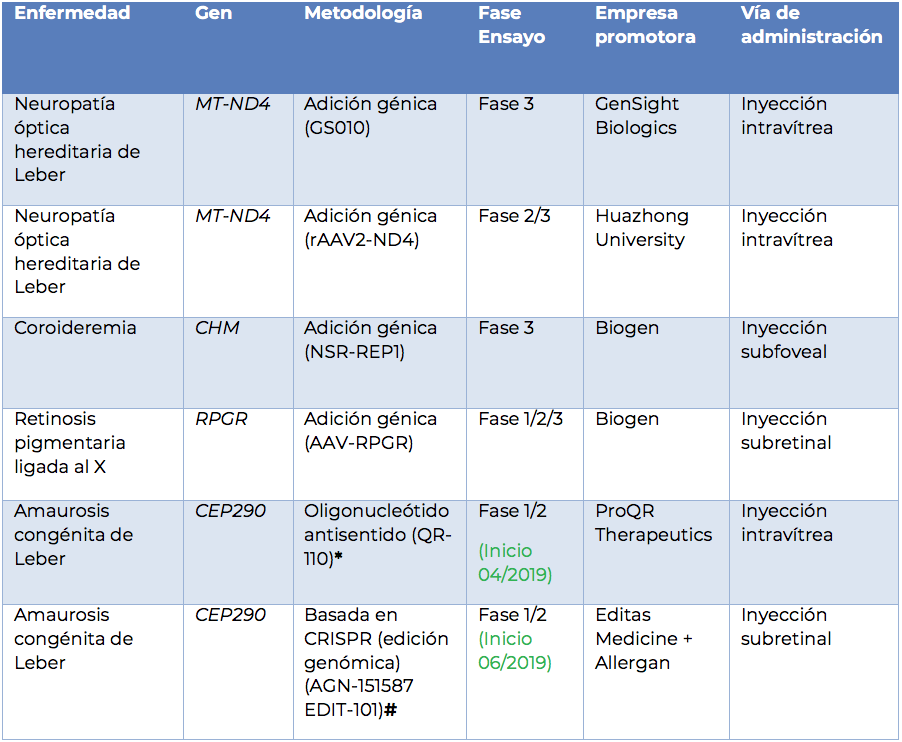

*ProQR está desarrollando un nuevo fármaco, sepofarsen (QR-110), para pacientes con LCA10 debido a la mutación p.Cys998X, también conocida como mutación c.2991+1655A> G, en el gen CEP290.
#Estudio abierto, de dosis única ascendente, para evaluar la seguridad, tolerabilidad y eficacia de AGN-151587 (EDIT-101) en pacientes adultos y pediátricos con amaurosis congénita de Leber tipo 10 (LCA10) causada por una mutación heterocigótica compuesta u homocigótica c.2991+1655A> G en el intrón 26 (IVS26) del gen CEP290(«LCA10-IVS26»).
Una de las cuestiones más apremiantes para los pacientes y sus familias es cómo acceder a estas terapias. Los ensayos clínicos reclutan a pacientes que deben cumplir unos requisitos clínicos determinados. Los pacientes y médicos interesados deben ponerse en contacto con los hospitales y las compañías farmacéuticas que realizan estos ensayos para solicitar su idoneidad.
La terapia ya aprobada con Luxturna, desarrollada inicialmente por Spark Therapeutics, tiene un coste elevado. La comercializa Roche en Estados Unidos y Canadá, y Novartis en Europa y en el resto del mundo. En Estados Unidos, el coste del tratamiento —mediante microinyección del virus que transporta el gen RPE65 en el espacio subretiniano— es de 850.000 dólares por paciente (dos ojos).
¿Cuál es el coste del tratamiento con Luxturna en Europa? ¿Los servicios/agencias nacionales de salud sufragan estos tratamientos?
La Agencia Europea de Medicamentos (EMA), institución europea equivalente a la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), ha autorizado la comercialización de Luxturna en Europa, pero advierte que las decisiones sobre el precio y el reembolso se tomarán a nivel de cada Estado miembro.
En el Reino Unido, el NICE (Instituto Nacional de Salud y Excelencia en la Atención Médica) aprobó recientemente que los costos de esta terapia génica serán cubiertos por el Servicio Nacional de Salud (NHS). Los gobiernos de Alemania, Francia e Italia están negociando con Novartis los costes derivados de incluir Luxturna durante un período de tiempo en su cartera de servicios terapéuticos para enfermedades raras.
Otros gobiernos europeos también podrían estar negociando con la empresa, pero por el momento, no hay información pública disponible. Teniendo en cuenta que el margen de tiempo de aplicación de esta terapia en pacientes pediátricos es limitado, es importante negociar rápido, el factor tiempo es esencial.
